ВНУТРІШНЕ ОБЕРТАННЯ МОЛЕКУЛ - Хімічна енциклопедія
ВНУТРІШНЕ ОБЕРТАННЯ МОЛЕКУЛ, обертання фрагментів молекули відносно один одного навколо хімічної, що з'єднує їх. зв'язку. Обумовлює виникнення разл. конформацій молекули, що характеризуються певними значеннями потенційної енергії Остання змінюється періодично за зміни кута відносить. повороту фрагментів молекули (дзиги) і описується потенційною ф-цією внутр. обертання. Максимуми потенційних кривих (див. рис. 1) відповідають нестабільним конформаціям, мінімуми – стабільним. Висота максимуму стосовно сусіднього мінімуму зв. потенційним бар'єром внутрішнього обертання V0. Залежно від співвідношення значень V0 і теплової енергії молекул, що дорівнює kT (k-постійна Больцмана, Т - абс. т-ра К), розрізняють своб. внутрішнє обертання, коли V0k Т (напр., обертання метальних груп в СН3СССН3), і загальмоване внутрішнє обертання, коли V0kT (напр., С2Нб, для якого V0 = 12,5 кДж/моль). При V0kT внутрішнє обертання відсутня, як, наприклад, в молекулі СН2=СН2 при звичайних т-рах. За вільн. внутрішньому обертанні будь-які відносить. орієнтації обертових груп (тобто всі конформації) практично рівноймовірні. При загальмованому внутрішньому обертанні та його відсутності існують переважно. стабільні конформації, причому в першому випадку між ними здійснюються конформаційні переходи, а в другому немає. Поява потенційного бар'єру внутрішнього обертання навколо одинарного зв'язку приблизно можна пояснити невалентними взаємодією. атомів обертових фрагментів, природа яких брала та ж, що й у міжмолекулярної взаємодії. Суворіше пояснення м. б. отримано за квантовоміх. розгляді з використанням неемпірич. методів.
Число максимумів (і мінімумів) потенційної ф-ції внутрішнього обертання в межах від 0до(тобто. кратність бар'єру , де l-період ф-ції) залежить від природи атомів, що зв'язують фрагменти молекули, що обертаються, числа і кратності утворених кожним з цих атомів зв'язків і від валентних кутів. Так, для молекули Н2О2 бар'єр дворазовий, С2Н6 - трикратний, для CH3BF2-шестикратный. Чим вище порядок зв'язку, навколо якого відбувається обертання, тим більше величина V0. Загальний вираз можна уявити мат. поряд Фур'є:
де а0, am - Коеф., Т = 1,2,3. Що стосується симетричного триразового бар'єру (напр., коли дзига - група СН3, має поворотну вісь симетрії 3-го порядку С3) п = 3, і за , тобто. визначає положення мінімумів (V = 0) і максимумів (V = V0) потенційної кривої; наступні члени низки уточнюватимуть лише її форму (крутість). Вирішення відповідної квантовоміх. Завдання при заданому баченні в принципі дозволяє знайти набір енергетич. рівнів для загальмованого внутрішнього обертання. Загальний характер рівнів енергії для триразового бар'єру показано на рис. 1.
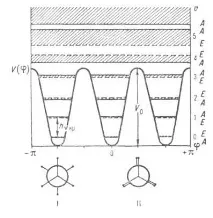
Мал. 1. Потенційна функція та рівні енергії загальмованого внутрішнього обертання для молекул, подібних до етану. I-стабільні загальмовані (шахові) конформації, II - заслонені нестабільні конформації.
Термін "обертання" не є суворим і вичерпним. При високих бар'єрах у нижній. Частини потенційних ям система рівнів енергії більше відповідає коливань. характеру руху та м. б. описана навіть у наближенні гармонійного осцилятора: E(v) = hvкр(v + 1/2) де v-колебат. квантове число, vкр - астота крутильного коливання (тобто частота переходу; на рис. 1 показаний стрілкою). Вона пов'язана з V0 наближеною ф-лою: , де Iпр = (I1I2)/(I1 +I2) - наведений момент інерції (I1 і I2-моменти інерції груп атомів, що обертаються одна щодо іншої). Суворіше рішенняпризводить до появи повносиметричного А та виродженого? підрівнів, що належать до даного значення v, причому розщеплення, показане на рис. 1 заштрихованими областями, що відображає обертають. характер внутрішньомол. руху. При великих V0 і малих v розщеплення А-Е дуже мало, але в міру наближення до вершини бар'єра (збільшення v) це розщеплення (або роль обертання) зростає. Вище бар'єру відстані між підрівнями А і Е з тим самим значенням v стають навіть набагато більше, ніж між заштрихованими областями рішень з різними v, тобто. повністю переважає обертання. При V0О квантовоміх. завдання вирішується як і, як своб. ротатора: де J - обертальне квантове число.
За відсутності осьової симетрії дзиґрів, напр. в молекулах 1,2-дизаміщених етану, загальмоване внутрішнє обертання призводить до явища поворотної ізомерії, що представляє собою окремий випадок конформаційної ізомерії (див. Конформаційний аналіз), коли стійким конформаціям відповідають різні за глибиною мінімуми потенційної енергії, тобто виникають та св-вам поворотні ізомери (конформери). Зокрема, у молекул типу 1,2-дизаміщених етану є три стабільні конформації - одна транс- (або анти-) і дві гош-конформації (див. рис. 2). Відносить. стабільність поворотних ізомерів визначається різницею їхньої енергій, тобто. різницею значень енергії у мінімумах потенційної кривої. Напр., транс-ізомер 1,2-дихлоретан більш стійкий, ніж гош-ізомер, т.к. його енергія (у газовій фазі) нижче
5,6 кДж/моль. При досить низьких потенційних бар'єрах (дек. десятків кДж/моль) поворотні ізомери перебувають у термодинамічні. рівновазі, положення якого залежить від т-ри, тиску і природи середовища. Для бар'єрів порядку Ш кДж/моль час життя конформерівскладає
10-10 с. При високих значеннях VQ (вище
100 кДж/моль), коли внутрішнє обертання відсутня, конформери навіть за малої різниці їх енергій можуть існувати як індивідуальні в-ва. Внутрішнє обертання молекул можливе в газовій та рідкій фазах, параметри залежать від характеру середовища та електронного стану молекули. У кристалах внутрішнє обертання, зазвичай, відсутня і стабільний лише один конформер; іноді існують тверді фази (напр., у деяких фреонів), у яких стабільні різні конформери та між ними здійснюються переходи.
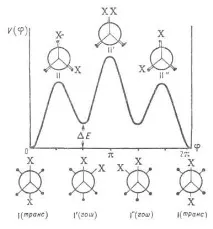
Мал. 2. Потенційна функція внутрішнього обертання молекул типу 1,2-дизамішаного етану. I-I''-поворотні ізомери (конформери), або стабільні загальмовані конформації, II-II''-нестабільні заслонені конформації.
Явлення загальмованого внутрішнього обертання та поворотної ізомерії молекул впливають на термодинамічні, електрич., оптичні. та ін св-ва речовин. Внутрішнє обертання необхідно враховувати при розрахунку термодинаміч. ф-цій методами статистич. термодинаміки. Напр., для CH3SH дослідне значення ентропії 5^79 12 = 251,7 Дж/(моль*К), а розрахункове (без урахування внутрішнього обертання) на 8,4 Дж/(моль*К) менше. З іншого боку, якщо виходити з припущення про вільне внутрішнє обертання, розрахункова величина S o 279,12 перевищує дослідну на 2,0 Дж/(моль*К); отже, в молекулі CH3SH існує загальмоване внутрішнє обертання навколо зв'язку С-S.
У разі поворотної ізомерії св-ва в-ва Визначаються як св-ва рівноважної суміші ізомерів і залежить від внеш. умов, що впливають положення рівноваги. Напр., ефективний дипольний момент залежить від т-ри. Якщо поворотних ізомерів різні, як, напр., у транс- ( = 0) і гош-конформерів 1,2-дихлоретан, то при зміні т-ри значеннявимірюваного буде наближатися до значення, характерного для ізомеру, концентрація якого буде при цьому зростати. молекул р-телегля і розчиненого в-ва. Поворотні ізомери, маючи разл. рівноважні зміни, відрізняються своїми коливаннями. та обертають. спектрами. При збільшенні числа осей внутрішнього обертання в молекулі зростає кількість її можливих конформацій.
Уявлення, пов'язані з внутрішнім обертанням і поворотною ізомерією молекул, застосовують теоретично будови як низькомол., і високомол. з'єднань. Розроблено методи та схеми конформаційних розрахунків досить складних молекулярних систем на основі хутра. моделей, отримали також розвиток напівемпірич. та неемпірич. квантовоміх. розрахунки потенційних ф-цій внутрішнього обертання молекул Для вивчення явищ внутрішнього обертання та поворотної ізомерії молекул використовують методи спектроскопії: ІЧ, комбінац. розсіювання, мікрохвильової, УФ, ЯМР, ЕПР, а також методи газової електронографії, поглинання ультразвуку, некогерентного, непружного розсіювання нейтронів, вимірювання дипольних моментів, діелектрич. втрат та ін.
=== Ісп. література для статті «ВНУТРІШНЕ ОБЕРТАННЯ МОЛЕКУЛ» : МідзусімаС, Будова молекул і внутрішнє обертання, пров. з англ., М., 1957; Волькенштейн М.В., Конфігураційна статистика полімерних ланцюгів, М.-Л., 1959; Пентін Ю. А., Обертальна ізомерія молекул, М., 1969; Внутрішнє обертання молекул під ред. В.Дж. Орвілл-Томаса, пров. з англ., М., 1977. Ю.А. Пентіна.
Сторінка «ВНУТРІШНЕ ОБЕРТАННЯ МОЛЕКУЛ» підготовлено за матеріалами хімічної енциклопедії.